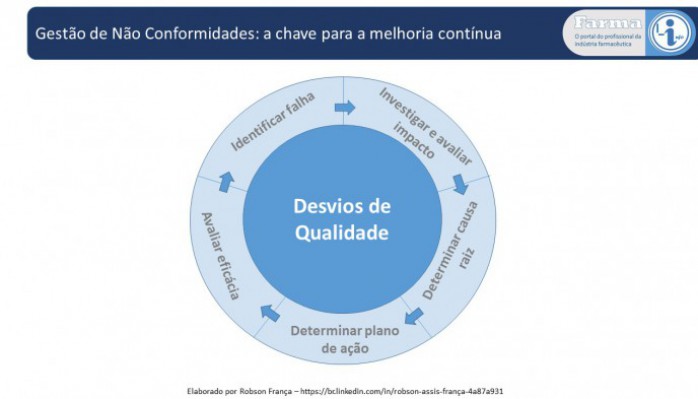
Gestão de Não Conformidades: a chave para a melhoria contínua
Qualquer processo, seja produtivo ou não, é susceptível a falhas sendo que estas podem ou não gerar consequências nos produtos finais. Na indústria farmacêutica a gestão destas falhas além de ser uma das demandas do sistema de qualidade, é uma necessidade legal, a qual é verificada por auditorias de todas as agências regulatórias. Portanto, a gestão das não conformidades apresenta grande importância para a melhoria contínua quanto para a conformidade regulatória. Neste contexto, falhas podem ser detectadas pelos sistemas de auditoria, reclamações de mercado ou de desvios de qualidade, sendo que este texto se concentrará em discutir o último tópico.
Qual é a classificação e categorização de desvios?
Segundo a RDC 17/2010 um desvio de qualidade é o afastamento dos parâmetros de qualidade estabelecidos para um produto ou processo, sendo que em vários artigos ela determina que estes devem ser relatados, investigados e devidamente documentados. Os sistemas de qualidade das indústrias farmacêuticas apresentam ferramentas para que haja o relato e classificação inicial da criticidade, normalmente dividida em três níveis (crítico, maior, menor), sendo que cada empresa utiliza a nomenclatura que achar mais pertinente. Além disso, há categorização do tipo de desvio, sendo normalmente dividido em desvios (ocorreu no passado) e desvios planejados (ocorrerá no futuro). Em empresas com cultura de qualidade mais madura, também é utilizado a categoria de incidentes de qualidade / desvios não investigativos, sendo que estes normalmente relatam pequenas falhas que não precisam de investigação robusta para determinação de causa raiz e de ações corretivas e preventivas.
A clara determinação das classificações e categorias, assim como o treinamento das equipes é de fundamental importância para que os recursos sejam corretamente direcionados para a conformidade regulatória e melhoria contínua. Se durante a avaliação inicial o desvio foi considerado como menor e não foi diagnosticado que a falha é reincidente, deve-se concentrar esforços na avaliação de impacto dos produtos produzidos, assinalar a causa raiz e determinar ações corretivas e preventivas para evitar a falha. Para casos reincidentes, ou com maior impacto no sistema de qualidade e/ou produtos, se faz necessário uma avaliação completa e robusta, correlacionando todas as informações disponíveis para chegar a verdadeira causa raiz. Este equilíbrio não é fácil de se encontrar na prática, sendo que o que se vê geralmente é que a balança pesa para algum dos lados (investigações complexas para questões simples ou superficiais em qualquer questão). O desafio do profissional da qualidade é balancear este processo, estimulando as equipes a trabalhar dentro da melhor relação custo benefício. Vale ressaltar que as exigências documentais variam entre as agências regulatórias, sendo que a empresa precisa se adaptar à realidade do mercado consumidor ao qual ela está atendendo (ANVISA, EMEA, FDA, INVIMA, DIGEMID, MAPA, etc).
Qual a importância da atribuição da causa raiz?
Determinar a verdadeira causa raiz vem sendo um dos desafios dos profissionais da qualidade no ambiente farmacêutico. Para tanto existem uma série de formulários e ferramentas para auxiliar as equipes nesta atividade, sendo as mais utilizadas os 5 porquês e o diagrama causa efeito. As informações que devem ser minimamente documentadas numa investigação estão descritas abaixo:
a) - Descrição resumida do desvio com os lotes ou sistemas/áreas envolvidas
b) - Avaliação de impacto da falha assim como as ações imediatas (segregação, reprovação, aprovação, etc)
c) - O histórico do ocorrido, englobando os acontecimentos no período em que a falha ocorreu
d) - Detalhamento do processo produtivo ou administrativo em que ocorreu a falha
e) - Levantamento de controles de mudança, reclamações de mercado ou desvios anteriores que possam estar correlacionados
f) - Detalhamento da investigação justificando a inclusão ou exclusão de causas raízes
g) - Conclusão do desvio e parecer sobre os lotes ou sistemas/áreas envolvidas
h) - Plano de ação com ações corretivas e preventivas.
A extensão das informações a serem documentadas irá depender da criticidade e da complexidade da falha, sendo que o profissional da qualidade deve direcionar as equipes durante a investigação ou na análise crítica. Outra questão que é pouco discutida, mas é de suma importância para qualquer investigação (simples ou complexa), é a avaliação de impacto da falha. Nesta avaliação deve-se entender a luz do pensamento científico qual é o impacto na qualidade, segurança e eficácia dos lotes produzidos. Deve-se documentar se as barreiras existentes funcionaram e foram adequadas para conter o desvio, não gerando impacto para o cliente final. Além disso, do ponto de vista sanitário, o órgão fiscalizador quer ter segurança que todas ações foram tomadas e que não há risco para população. Portanto, documente todas ações e avaliações realizadas, elas podem ser óbvias, porém são a evidência de que tudo ocorreu de forma controlada.
Após determinar a verdadeira causa raiz e os planos de ação, deve-se garantir que esta informação é entendida e divulgada pelos diversos níveis da empresa, de modo a garantir a melhoria contínua. Uma das maneiras para que isto ocorra é ter um catálogo adequado e devidamente divulgado, de forma que informação seja rapidamente entendida. Uma sugestão é utilizar os 6 M com subdivisões de falhas, sendo que deveriam ter no máximo 4 falhas por “M” e não deveria existir a opção “outros”. Este é um ponto pouco explorado na prática e na opinião do autor é a chave para uma avaliação de tendência adequada e direcionada, gerando planos de ação sistêmicos adequados para a companhia.
Quais indicadores monitorar?
No mínimo deve-se monitorar a aderência ao prazo de investigações, o número de CAPA abertos/fechados/atrasados/prorrogados e o número de desvios críticos ou que geram impacto financeiro / logístico na companhia.
A aderência ao prazo de investigações pode indicar o grau de maturidade do sistema de qualidade, sendo que quanto menor a porcentagem, menor é o envolvimento de todos os departamentos no sistema de desvios. Também é uma medida indireta do impacto dos desvios no lead time da companhia, uma vez que no ambiente da indústria farmacêutica qualquer falha que impacte produtos deve ser investigada e registrada antes do parecer sobre o lote.
O monitoramento de CAPA tem sido muito discutido nos últimos anos, principalmente pelo número de não conformidades que o FDA tem dado em inspeções devido a administração não adequada. Para promover a melhoria contínua e conformidade regulatória, é fundamental que os problemas sejam identificados, a causa raiz descoberta, as ações determinadas e cumpridas no prazo e a efetividade avaliada após implementação. Conforme o estágio de evolução do sistema de qualidade, são detectadas falhas em uma das etapas acima, na ordem que foram apresentadas. A administração de CAPA é operacionalmente trabalhosa pois exige constante acompanhamento do status, verificação de evidências de cumprimento e avaliação de efetividade. Além disso, é necessário controlar o número de reagendamentos de prazos e o impacto no sistema de qualidade.
Os dois indicares apresentados são fundamentais para o bom funcionamento do sistema de qualidade, portanto o profissional da qualidade deve sempre ter esta informação em mãos e divulgar as equipes operacionais, sendo que oportunamente, as níveis gerenciais e executivos, visando o fortalecimento da cultura da qualidade.
O número de desvios críticos ou que geram impacto financeiro / logístico na companhia é um indicador executivo que sinaliza de forma global as principais preocupações ou consequências do sistema de qualidade. Deve ser acompanhado para verificar tendências e o profissional da qualidade deve direcionar a companhia para que este se aproxime de zero, uma vez que indica segurança na operação e diminuiu o risco de perdas financeiras por defeitos ou atrasos